研究
私たちは、神経細胞とグリア細胞、血管細胞等で構成される脳内の環境がどのように維持されているか、更にその破綻がどのようにして疾患の発症に結びつくのか、というテーマで以下の研究を行っています。
- 小胞体ストレス応答による脳内環境維持とその破綻
- アストロサイトによる脳内環境の改善
- 自閉症関連遺伝子による脳内代謝制御とグリアネットワークの形成
- 末梢細胞による脳内炎症の誘導とその制御
以下、それぞれについて説明します。
1.小胞体ストレス応答による脳内環境維持とその破綻
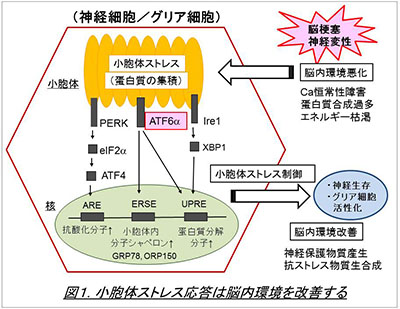
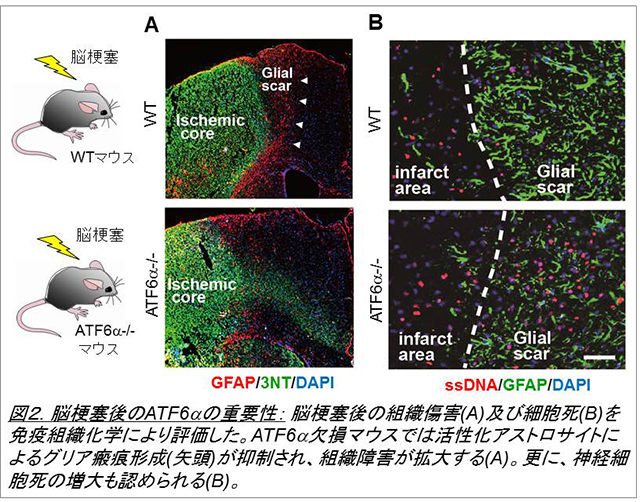
神経細胞は環境変化にきわめて弱く、例えば脳梗塞の際に、短時間で細胞死に至ると考えられています。一方、グリア細胞の一つであるアストロサイトはこの環境変化に対して強く、虚血環境でもかなり生き延びることができます。私たちはこのアストロサイトにおけるストレス応答に注目し、そのメカニズムを解析しました。そして、細胞内小器官の一つである小胞体におけるストレス応答が、脳環境の維持に重要であることを見出しました(図1, Tamatani et al., Nat Med. 2001, Hori et al, J Cell Biol. 2002)。小胞体ストレスは脳虚血(脳梗塞)以外にも、神経変性や外傷などの病態で発生しますが、これまでその詳細については不明でした。私たちは小胞体ストレス応答の主要3経路のうち、特にATF6α経路についてノックアウトマウスや培養細胞系を用いた解析を行い、同経路が神経細胞の生存(Hashida et al., 2012, Kezuka et al., 2016)を促進するほか、アストロサイトやミクログリア等のグリア細胞の活性化(図2, Yoshikawa et al., Ta et al., 2016)にも必要であることを明らかにしました。ATF6α経路は分子シャペロンの発現などを介して小胞体環境の改善に役立つと考えられており、今後は、本経路を利用することで、脳梗塞や神経変性疾患で起こる神経細胞死を抑制できないか、と考えています。
2.アストロサイトによる脳内環境の改善
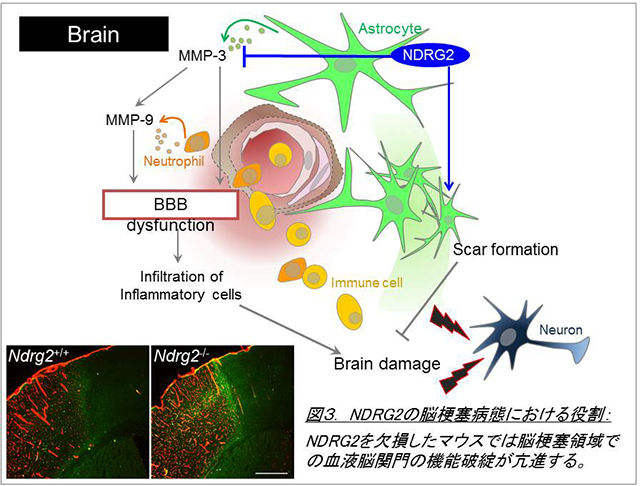
最近の研究から、アストロサイトは単に神経細胞を補助するだけの細胞ではなく、積極的に神経伝達や血流を制御し、障害時には脳環境の悪化に応答する極めて重要な細胞であることがわかってきています。私たちは中枢神経系でアストロサイト特異的に発現する新規分化関連遺伝子NDRG2 (N-myc downstream regulated gene2)が、マウスパーキンソン病モデルおよび患者脳において活性化アストロサイトに強発現することを見出しました(Takeichi et al., 2011)。次に、NDRG2のノックアウトマウスを作製し、脳損傷モデルを用いて個体レベルでの解析を行った結果、NDRG2はIL-6/STAT3経路を介してアストロサイトの早期活性化に促進的に働いていることを発見しました(Takarada-Iemata et al., 2014)。また、脳梗塞モデルにおいても、NDRG2はアストロサイトによるグリア瘢痕形成や血液脳関門破綻の抑制を介して、梗塞巣の拡大に拮抗的な役割を持つことを観察しました (Takarada-Iemata et al., 2018)。一方、炎症性脱髄疾患である多発性硬化症のモデルにおいてNDRG2はむしろグルタミン酸輸送体の発現制御を介し神経症状の増悪に働くことを見出しました(Le et al., 2018)。
これらのことは、様々な病態下において、アストロサイトがNDRG2を介して神経細胞の生存や組織修復に多様かつ重要な役割を果たしている可能性を示しています。現在、更にアストロサイトがNDRG2を介しどのように病態形成に関与するのか、その分子機構の解明を行っています。
3.自閉症関連遺伝子による脳内代謝制御とグリアネットワークの形成
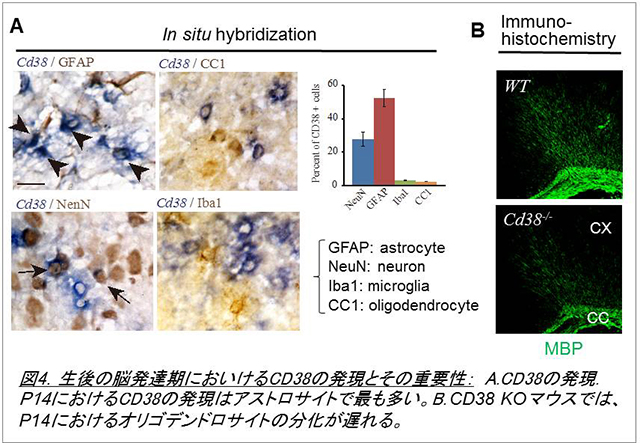
CD38は45kDaからなる膜蛋白質で、NAD+からcADPリボース、更にADPリボースを生成することが知られています。これまでの研究から、CD38ノックアウトマウスでは視床下部神経からのオキシトシン分泌量が低下し、母親の養育行動や社会的認識記憶に異常が認められることが明らかにされています(Jin et al., 2007)。このため、同マウスは自閉症モデルの一つと考えられています。一方、CD38は脳内でアストロサイトに最も強く発現していることから、私たちは特に生後発達期のグリア細胞及び神経細胞の発達にも影響を与えているのではないかという仮説を立てました。そして、野生型及びCD38ノックアウトマウスにおける生後のグリア発達、神経ネットワークの構築などについて検討を始めました。その結果、この時期においてもCD38は大脳皮質のアストロサイトで最も強く発現し、CD38ノックアウトマウスではアストロサイトの発達が遅延することを観察しました。更に興味深いことに、同マウスではオリゴデンドロサイトの分化も遅延することが明らかになりました(図4、Hattori et al., 2017)。そのメカニズムとして、基質であるNAD+が重要であることを発見しました。現在、アストロサイトに発現するCD38が脳内神経ネットワーク構築、更にマウスの行動にどのような影響を与えるか等について検討を行っています。
一方、CD38の欠損により引き起こされる脳内NAD+の増加はアルツハイマー病など病態モデルにおいては神経保護作用を持っていることが報告されています。今後、発達段階と病態下における脳内NAD+の役割の違いを明らかにできればと考えています。
4.末梢細胞による脳内炎症の誘導とその制御
脳内は血液脳関門を介して末梢組織から隔離されているため、通常は末梢の炎症が脳内には波及しない仕組みになっています。しかし、脳卒中などの病態ではこの関門が破壊され、白血球などの浸潤が認められます。私たちは、特にくも膜下出血や多発性硬化症の動物モデルを用いて、どのようにして末梢の炎症細胞が脳内に侵入し、脳内環境をどのように変化させるか等について解析を行っています。
研究室で使用している疾患モデル動物(マウス)
| 脳梗塞 | 中大脳動脈閉塞モデル、両側総頚動脈閉塞モデル |
| パーキンソン病 | MPTP投与モデル、6-OHDA投与モデル |
| 頭部外傷 | Stab injuryモデル |
| 海馬神経細胞死 | カイニン酸投与モデル |
| 筋委縮性側索硬化症 | SOD G93Aトランスジェニックマウスモデル |
| 多発性硬化症 | MOG投与モデル |
| 緑内障 | 視神経損傷モデル |
| 自閉症 | CD38ノックアウトマウス |